对生物体中多种复杂蛋白质结构的自然进化自组装的观察,激发了人们对利用肽和蛋白质的自组装来制造功能性纳米材料的极大兴趣。由于其结构、机械和功能多样性以及高生物相容性和可降解性的优势,自组装的肽纳米结构是促进生物医学应用的极有前景的候选者。本文重点关注利用肽的自组装来制造用于抗肿瘤光动力和光热治疗的光治疗纳米材料,重点讨论其组成部分、非共价相互作用、策略以及自组装的纳米结构。还深入讨论了这些光治疗纳米材料所实现的令人兴奋的抗肿瘤活性,以及其特定纳米结构与其独特性能之间的关系,以加深对肽自组装在提高光动力和光热治疗效率方面所起作用的理解。
光疗,包括光动力疗法(PDT)和光热疗法(PTT),是治疗癌症的吸引人的非侵入性技术。总的来说,光疗涉及两个主要步骤,首先是将光治疗剂递送至肿瘤,其次是使用特定光线照射肿瘤部位以激活光治疗剂。由于光治疗剂在黑暗中必须本质上是无毒的,并且光诱导的毒性可以通过定向光照射限制在受限区域,因此光疗没有显著的全身性毒性副作用,这使得光疗比化疗和放疗具有更好的空间选择性和侵袭性。在光动力疗法中,在光照射下,光治疗剂,也称为光敏剂,与分子氧反应并将其转化为活性氧物质(ROS),如单线态氧,通过氧化应激破坏肿瘤细胞和组织,导致肿瘤消融。自1993年在加拿大首次获得临床批准用于膀胱癌的预防性治疗以来,光动力疗法已成为最具有位点特异性的癌症治疗方法,并已获得临床批准用于治疗各种癌症,如头颈部癌症、食管癌、支气管内癌、胃癌、宫颈癌和膀胱乳头状癌。光动力疗法还与手术和其他传统治疗方法结合使用,作为协同抗肿瘤疗法的一部分。尽管光动力疗法取得了成功应用,但由于其局限性,如可见光的穿透性有限和光敏剂对肿瘤的选择性缺乏,光动力疗法仍被视为一种替代或辅助治疗方法。随着纳米技术的发展,基于纳米材料的PDT被视为克服当前PDT局限性的有前景的方法。纳米颗粒不仅可以提高光敏剂的溶解性,还提供了一个平台来封装新的吸光分子,特别是那些能够吸收近红外(NIR)光的分子,作为PDT的候选物。此外,纳米粒子通过增强渗透和滞留(EPR)效应或通过使用靶向配体进行表面改性,增强了对肿瘤的选择性。
在光热疗法中,光热剂(通常是吸光纳米材料)吸收的光能转化为热能,直接导致肿瘤细胞的消融。各种具有近红外吸收能力的纳米材料已被广泛研究对光热疗法(PTT)进行了研究,主要包括金纳米粒子、碳纳米结构和吸光聚合物。然而,光热疗法尚未获得临床批准,很可能是由于这些纳米材料的长期安全性尚未得到证明。优秀的光热治疗剂应具有在近红外区域强吸收、增强肿瘤选择性聚集、高光热转换效率以及良好的生物相容性和可降解性的特点。显然,光动力疗法(PDT)和光热疗法所需的光治疗剂有一些共同特征,如近红外吸收、肿瘤选择性聚集以及高生物相容性和可降解性。同时,光动力疗法和光热疗法对光治疗剂也有不同的要求。例如,对于光动力疗法,封装的光敏剂应迅速从纳米粒子中释放为单体进入细胞,以恢复其活性氧(ROS)生成能力;而对于光热疗法,负载的光吸收分子需要保持聚集状态以获得高光热转换效率。
为了提高光疗的治疗效果,具有生物相容性和可降解性,并且能够以可控方式构建以满足光动力疗法(PDT)和光热疗法(PTT)特定需求的自组装肽纳米结构,正引起巨大的综合关注。在此,我们重点介绍了光动力疗法和光热疗法中基于肽的纳米材料设计的最新进展(图1)。我们首先根据其构建单元的类型对肽纳米结构进行分类。然后,我们重点研究了这些构建单元自组装过程中涉及的非共价相互作用,以及非共价相互作用的变化对形成的超分子纳米结构的影响。在某些情况下,光吸收分子不仅作为负载药物呈现,还参与自组装过程,并提供非共价相互作用以形成纳米结构。基于对自组装肽基纳米材料的性质、功能和应用作为光疗剂的讨论,我们试图深入理解超分子纳米结构与治疗效率之间的关系。最后介绍了在光动力疗法(PDT)和光热疗法(PTT)领域中肽的自组装情况的挑战与未来展望。
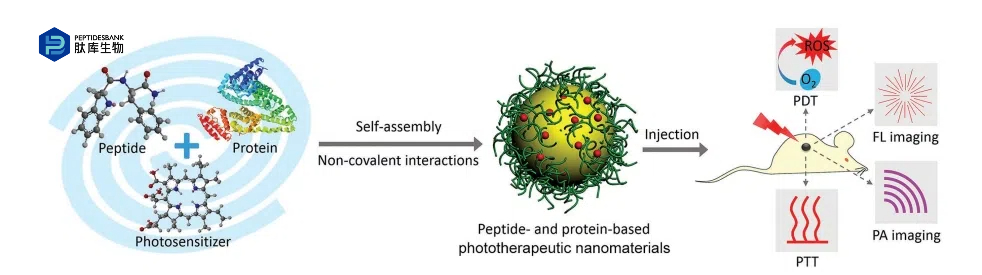
图 1 。示意图展示了在光治疗纳米材料的制造中,通过非共价相互作用实现肽的自组装,用于光动力疗法(PDT)、光热疗法(PTT)以及荧光(FL)成像和光声(PA)成像的诊断方式。
2. 用于光动力疗法(PDT)和光热疗法(PTT)的自组装肽基纳米材料
肽是由氨基酸组成的,是生物体内的基本组成部分。氨基酸包含氨基和羧基。侧链的极性、电荷、疏水性和大小的变化决定了氨基酸的各种物理化学性质。因此,肽中氨基酸的数量和序列决定了肽的自组装行为。肽的结构和性质的灵活性为制造具有可控特性的特定类型的纳米材料提供了可能性。各种类型的肽基块,如环肽、芳香二肽、两亲性肽和聚肽,已被开发用于构建超分子纳米结构。自组装肽纳米颗粒在生物医学领域备受关注,特别是在药物递送和其他癌症治疗的强大技术中,因为肽基纳米颗粒具有生物相容性、生物利用性和生物安全性的优势。此外,肽与吸光分子之间的相互作用为调整光敏剂和光热剂的物理化学性质提供了机会,从而形成具有可控光治疗效果的纳米颗粒。因此,基于肽的纳米材料在光动力和光热应用方面具有很高的潜力。
2.1. 用于光动力疗法(PDT)和光热疗法(PTT)的基于短肽的纳米材料
由几个氨基酸组成的短肽是纳米颗粒的优良构建模块,因为它们可以通过设计调节结构,并且易于合成。自组装短肽通常是两亲性肽,具有疏水和亲水特性。因此,在形成的纳米材料中,疏水区域可以通过非共价相互作用加载疏水光敏剂。当自组装肽基纳米材料应用于体内时,由于体液的稀释、与复杂生理成分的相互作用以及酶的降解,这些纳米材料可能在到达和聚集在肿瘤之前就被分解。为了解决这个问题,已经提出了几种稳定组装纳米材料的方法:(i)将半胱氨酸残基引入肽链中,以将肽链锁定在组装状态,并通过分子间二硫键的形成来稳定纳米材料;(ii)整合含有高度疏水残基的氨基酸,以增强疏水相互作用,并促进在低浓度下形成稳定的纳米材料;(iii)按需使用对酶无特异性反应的氨基酸序列。例如,据报道,具有序列为 Ac-Ala-Ala-Val-Val-Leu-Leu-Leu-Trp-Glu-Glu 的短肽的自组装形成了平均直径为 120 纳米的囊泡。通过在肽链的疏水部分引入多个半胱氨酸残基以及形成分子间二硫键,这些囊泡得到了进一步稳定。一种疏水光敏剂——锌卟啉,在短肽摩尔过量 10 倍的情况下成功负载到囊泡中。在光照射下,含有锌卟啉的肽囊泡对 COS-7 细胞显示出显著的光细胞毒性。相比之下,不含锌-卟啉的肽体和对照组的游离锌-卟啉没有显著的细胞毒性,这表明肽体载体增强了光敏剂的内化。由表面活性剂类似的四尾两亲性肽(含四个高度疏水的脂肪尾和一个靶向序列 Arg-Gly Asp(RGD))自组装的胶束也表现出作为药物递送载体的能力,用于负载光敏剂。由于存在 RGD,胶束可以被 HeLa 细胞特异性地识别和内化,从而提高了负载物的细胞内浓度。
基于短肽的纳米材料的优势在于,肽的序列可以被定制为具有功能性。已经证明,由包含基质金属蛋白酶-2(MMP-2)敏感序列的光敏剂-肽偶联物自组装的纳米颗粒可以作为靶向光动力治疗(PDT)的药物递送系统。该偶联物由卟啉(PpIX)作为光敏剂,R9作为细胞穿透肽,GPLGLAG作为MMP-2 敏感肽,以及E8作为掩蔽肽。在正常组织中,细胞穿透肽通过静电吸引力被掩蔽肽阻断。在肿瘤细胞外基质中,存在过度表达的 MMP-2 蛋白,掩蔽肽被MMP-2去除,导致细胞穿透肽功能恢复。体内结果表明,该缀合物在肿瘤部位有效积累。还发现这种(MMP-2)敏感肽在设计用于光动力疗法和基因疗法联合治疗以及聚集诱导发射引导的光动力疗法的药物递送系统方面是有效的。最近还展示了在制造药物递送系统时应用阳离子核定位肽序列。
在自组装短肽中,二苯丙氨酸(FF)是一种具有众多明确纳米结构的代表性分子。[7a] FF具有疏水和亲水部分,这是分子自组装的关键参数。除了自组装本身,FF还作为共组装肽,用于调节各种功能分子的自组装,提供了一种简便高效的方法来调节这些功能分子的形态和性质。最近,我们小组证明了,短肽调节的光敏剂自组装是一种制造纳米颗粒以增强光动力治疗(PDT)的优雅方案。我们证明了,从FF衍生出的二苯丙氨酸((H-Phe-Phe-NH2·HCl, CDP)和一种氨基酸衍生物(9-芴基甲氧羰基-L-赖氨酸,Fmoc-L-Lys)都能诱导叶绿素e6(Ce6)的自组装形成有序纳米颗粒(图2A)。由于 CDP 和 Fmoc-L-Lys 均为具有芳香基团的阳离子两亲分子,而 Ce6 为具有芳香体系的无机离子分子,纳米粒子的形成是由包括π-π 堆叠、静电相互作用和疏水效应在内的几种非共价相互作用诱导的。所获得的具有代表性的 Fmoc-L-Lys/Ce6(FCNPs)和 CDP/Ce6(CCNPs)纳米粒子分别呈现出 200 纳米和 100 纳米的大小。
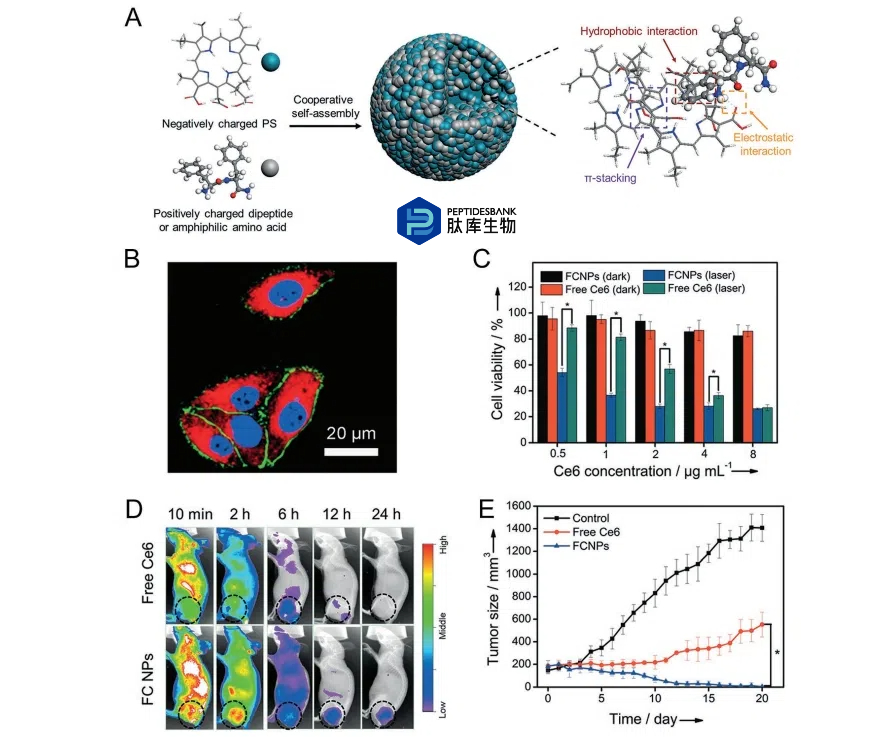 图 2 。用于光动力治疗(PDT)的光敏剂的两亲性二肽或氨基酸调节的自组装。A)自组装过程的示意图。B)MCF7 细胞内吞入组装好的荧光碳纳米颗粒(FCNPs)。红色染色来自光敏剂,蓝色用于细胞核染色,绿色用于细胞膜染色。C)FCNPs 的体外细胞毒性和光细胞毒性。D)荷瘤小鼠的荧光图像显示 FCNPs 和游离 Ce6 的体内分布。E)不同组小鼠的肿瘤生长曲线。
图 2 。用于光动力治疗(PDT)的光敏剂的两亲性二肽或氨基酸调节的自组装。A)自组装过程的示意图。B)MCF7 细胞内吞入组装好的荧光碳纳米颗粒(FCNPs)。红色染色来自光敏剂,蓝色用于细胞核染色,绿色用于细胞膜染色。C)FCNPs 的体外细胞毒性和光细胞毒性。D)荷瘤小鼠的荧光图像显示 FCNPs 和游离 Ce6 的体内分布。E)不同组小鼠的肿瘤生长曲线。
此外,通过改变肽与光敏剂的比例,可以轻松调节纳米颗粒的大小和表面电荷。重要的是,这些纳米颗粒对刺激物(如pH、洗涤剂和酶)有响应,有助于在肿瘤微环境中选择性释放光敏剂。当与MCF-7细胞一起培养时,FCNPs和CCNPs被有效内化(图2B)。根据IC50,与对照组的Ce6相比,纳米颗粒的光细胞毒性增加了约4倍(图2C)。从注射后24小时获得的体内荧光图像中,可以明显看出FCNPs和CCNPs在肿瘤中的选择性积累(图2D)。体内光动力疗法显示肿瘤消融增强(图2E)。光动力治疗后,小鼠没有显示出明显的器官损伤,体重也没有变化,表明短肽调谐的Ce6纳米结构具有高度的生物相容性。
除了在溶液中制备基于肽的纳米粒子外,另一种替代方法是在活体系统中原位构建功能性纳米粒子。通过一种响应性构建模块(图3A),在体内实现了肽-光敏化剂复合物的自组装,其中光敏化剂紫精-18(P18)通过酶响应肽连接子Pro-Leu-Gly Val-Arg-Gly(PLGVRG)与靶向配体RGD共价连接。形成的P18-PLGVRGRGD在生理溶液中可溶。在体内条件下,P18-PLGVRGRGD被动扩散在活体系统中,并通过其RGD配体靶向癌细胞。然后,通过过表达的酶,明胶酶,选择性地切割PLGVRG连接子。去除几个亲水性氨基酸生成了一种新的分子,该分子可以在生理条件下自组装(图3B)。因此,纳米纤维在原位形成,这种纤维状纳米结构表现出增强的光声信号和PTT效果(图3C)。基于肽的纳米结构的原位形成在细菌感染的光声检测中也显示出高效率,这表明肽和其他官能团在体内的自组装作为癌症诊断和治疗的新型策略具有巨大潜力。
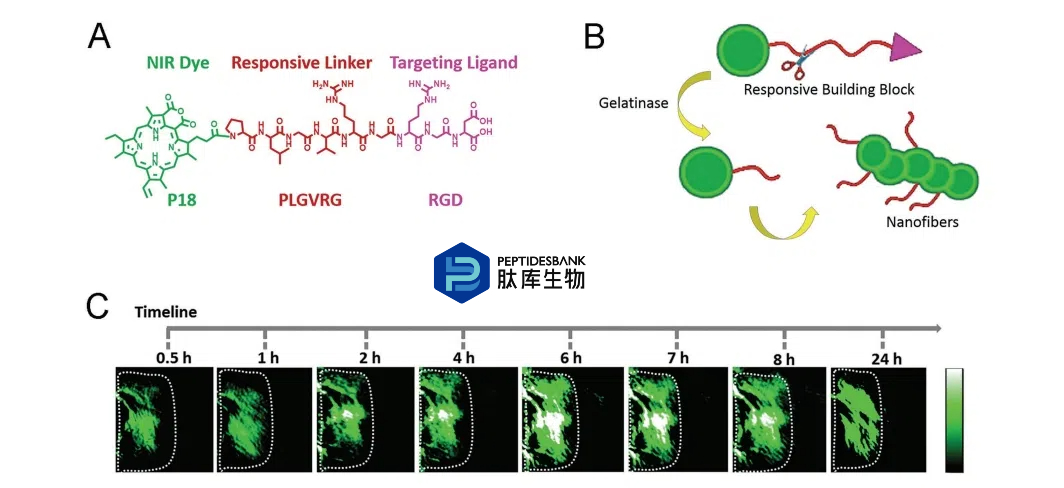 图3. 酶诱导原位形成纳米纤维,其光热效果增强。A) 响应性构建块的分子结构。B) 明胶诱导自组装的示意图。C) 注射响应性构建块后24小时内肿瘤横截面的光声图像。
图3. 酶诱导原位形成纳米纤维,其光热效果增强。A) 响应性构建块的分子结构。B) 明胶诱导自组装的示意图。C) 注射响应性构建块后24小时内肿瘤横截面的光声图像。
2.2. 用于光动力疗法(PDT)和光热疗法(PTT)的多肽基纳米材料
由多肽制备的药物递送载体因其内在的生物特性,在光敏剂递送方面备受关注。其中一个例子是通过聚乙二醇-接枝聚L-赖氨酸(PLL-g-PEG)递送卟啉钠。卟啉钠是一种临床上批准的光动力治疗(PDT)用光敏剂。尽管它已被证明对包括食管癌、早期非小细胞肺癌和巴雷特食管在内的各种癌症有效,但它仍有一些副作用,如皮肤光毒性反应的延长。患者需要避免阳光长达一个月。当卟啉钠与PLL-g-PEG在水溶液中混合时,得到了大小为29.2纳米的PLL-g-PEG/卟啉钠复合物。复合物的形成主要通过PLL-g-PEG的带正电荷的氨基与卟啉钠的带负电荷的羧基之间的静电相互作用。在小鼠体内的研究显示,通过PLL-g-PEG递送卟啉钠,肿瘤组织中卟啉钠的积累率得到了提高。此外,在接受PLL-g-PEG/卟啉钠治疗的小鼠中,发现光敏反应受到抑制。应当指出的是,PLL-g-PEG 具有很强的亲水性。因此,无论其负载与否,它都能以单个分子的形式分散在水中。
为了形成两亲性分子,人们提出了将水溶性肽与疏水性光敏剂结合。当将四段聚 L-赖氨酸(PLL)与疏水性卟啉核心结合时,它们生成了一种具有形成胶束能力的两亲性分子。所形成的胶束进一步被用作药物递送载体,用于递送阿霉素,这为化疗和光动力疗法的联合应用提供了一种可能的方法。
两亲性多肽可以通过引入具有疏水侧链的氨基酸来设计。例如,通过自组装构建了PEG-PLL-PLLeu(PEG-聚赖氨酸-聚亮氨酸)三嵌段共聚物,其中PLLeu形成疏水核心,PEG形成亲水外壳。在吲哚菁绿(ICG)存在的情况下,PEG-PLL-PLLeu自组装形成PEG-PLL-PLLeu-ICG多肽体(图4A)。ICG通过疏水相互作用与疏水核心结合,通过静电吸引力与亲水外壳结合。ICG是一种临床上批准的用于医学诊断的氰基染料,其吸收峰位于约800纳米。由于其在近红外范围内的吸收,ICG已被提议用于光疗。然而,其在水中不稳定,体内半衰期短(150至180秒),阻碍了其在肿瘤治疗中的生物医学应用。当ICG在黑暗中自由溶解5周后,其荧光几乎完全消失。在相同条件下,PEG-PLL-PLLeu-ICG 胶束仅损失约 30%的荧光强度,表明在多肽胶束的配方中,ICG 的水稳定性得到了增强。与游离的 ICG 相比,PEG-PLL-PLLeu-ICG 胶束还表现出增强的细胞内化作用,这是由于带正电荷的 PLL 片段与带负电荷的细胞膜之间的静电相互作用以及 PLLeu 片段与细胞膜之间的疏水相互作用。体外光热结果显示,用 PEG-PLL-PLLeu-ICG 胶束孵育并用近红外光照射的细胞被有效杀死(图 4B)。体内分析表明,PEG-PLL-PLLeu-ICG 通过EPR效应被动靶向肿瘤的能力令人印象深刻。
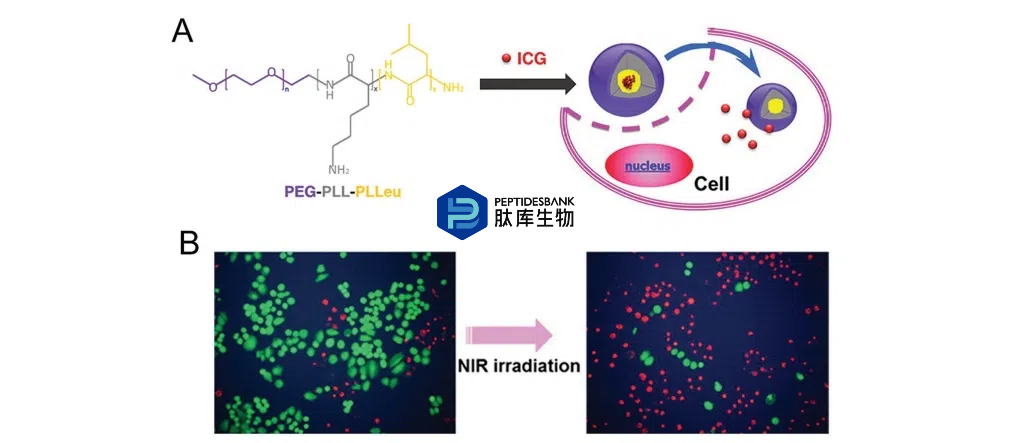 图4. 用于光热疗的聚集体聚多肽胶束。A) 聚多肽的结构以及通过自组装胶束负载和递送ICG。B) 与ICG含胶束孵育并接受808纳米激光照射的H460细胞的荧光图像。活细胞和死细胞分别用钙荧光白蛋白AM(绿色)和碘化丙啶(红色)表示。
图4. 用于光热疗的聚集体聚多肽胶束。A) 聚多肽的结构以及通过自组装胶束负载和递送ICG。B) 与ICG含胶束孵育并接受808纳米激光照射的H460细胞的荧光图像。活细胞和死细胞分别用钙荧光白蛋白AM(绿色)和碘化丙啶(红色)表示。
为了揭示非共价相互作用对光敏剂光稳定性的影响,合成了两种共聚物,聚乙二醇-聚(L-赖氨酸)(PEG-b-PLL)和聚乙二醇-聚(4-乙烯基吡啶)(PEG-b-P4VP)。通过阴离子磺酸盐基团与阳离子赖氨酸基团之间的静电相互作用,四(4-磺基苯基)卟啉(MgTPPS)与PEG-b-PLL的自组装形成了静电胶束,而通过卟啉中心金属与吡啶基团之间的配位相互作用,MgTPPS与PEG-b-P4VP的自组装形成了配位胶束。在水溶液中,由于镁离子被H+取代,MgTPPS的快速脱金属化发生。然而,发现MgTPPS在静电和配位胶束内部的水解稳定性得到了增强。此外,由于胶束核心对氧气的可及性降低,MgTPPS在胶束中的光稳定性得到了增强,表明肽与光敏剂之间的非共价相互作用在控制光敏剂的性质方面是有效的。PEG-b-PLL 与一系列聚苄醚树枝状聚合物卟啉(DPs)之间的非共价相互作用也有报道。通过带正电荷的 PLL 部分与带负电荷的 DPs 周边之间的静电相互作用,获得了聚离子体胶束。胶束的特性,包括荧光寿命、耗氧能力、细胞摄取和光细胞毒性,高度依赖于 DPs 的生成。
在复杂的体内环境中,通过肽与光敏剂之间的非共价相互作用组装的复合物通常会解离并释放光敏剂,使其成为游离的光敏剂。多肽作为药物递送载体的优势在于,多肽的侧链可以通过多功能基团进行定制。有人提出将 PLL 用作构建光动力治疗可追踪探针的聚合物主链。在这种策略中,PLL 通过四个功能基团进行功能化:二异丙基氨基(DPA)作为 pH 响应基团;叶绿素 A(PheA)作为聚集诱导猝灭(ACQ)光敏剂;四苯基硅酮(TPS)作为聚集诱导发射(AIEgens)的荧光团;PEG 用于进一步与靶向配体结合。在中性水溶液中,设计好的探针通过非共价相互作用(主要是疏水相互作用和来自 DPA、PheA 和 TPS 的π-堆叠)自组装形成大小为 115 纳米的纳米粒子。在照射下,纳米粒子显示出来自 TPS 的聚集诱导的绿色荧光,而来自 PheA 的红荧光和活性氧(ROS)被猝灭。相比之下,在酸性条件下,由于质子化的 DPA 亲水性增强,纳米颗粒的尺寸减小到 15 纳米。此外,由于纳米颗粒的解体,绿色荧光被高度猝灭,而来自 PheA 的红色荧光随着 PheA 光细胞毒性的恢复而恢复。基于其 pH 值依赖的自组装行为,该探针在光动力疗法中显示出可追溯性:绿色荧光的减少和红色荧光的增加表明,纳米颗粒已被溶酶体内部化(pH 值为 5.0);绿色荧光的恢复表明,溶酶体膜已被活性氧破坏,探针泄漏到胞质溶胶中。因此,该探针的设计为可追溯的癌症治疗提供了一种新颖的策略。
如前所述,体内自组装为原位构建纳米结构提供了一种优雅的方法。由于光动力疗法中涉及的活性氧是具有化学反应活性的物质,它们可以通过诱导新的化学键来作为体内自组装的触发因素。为了证明这一概念,设计了一种含周期性半胱氨酸残基和 Ce6 的重组弹性蛋白样多肽。当水溶性含 Ce6 的肽通过瘤内注射并用光照射时,Ce6 诱导的活性氧生成导致半胱氨酸硫醇原位交联,并形成稳定的水凝胶。发现水凝胶结构在皮下肿瘤异种移植物中非常稳定,并且能有效提高各种有效载荷在瘤内的滞留。
3.结论与未来展望
在此,我们对基于自组装肽的纳米材料在光疗方面的最新进展进行了全面综述。迄今为止,肽的自组装已得到广泛研究,所构建的超分子纳米结构已被证明能有效增强光疗的治疗效果。由于肽的构建模块的多样性和可控性以及非共价相互作用,在操纵纳米结构以满足有效光动力疗法(PDT)和光热疗法(PTT)的要求方面,存在大量空间。无论构建模块如何,使用自组装的肽纳米材料作为药物递送系统来制备光治疗剂,通常显示出改善亲水性光治疗剂在水溶液中的溶解性和稳定性、降低光治疗剂在黑暗中的可能毒性以及光毒性皮肤反应的副作用,并通过 EPR 效应增强肿瘤积累等优点。肽的超分子纳米粒子还为同时整合多种诊断功能(如荧光成像、光声成像和磁共振成像)以及光疗提供了一个平台。通过特殊设计,自组装的基于肽的纳米材料可以被赋予特定的特性,例如对肿瘤微环境的响应性,从而实现从纳米材料中触发释放光敏剂,以实现有效的光动力治疗和可追溯的光动力治疗。有趣的是,人们发现两亲性二肽甚至氨基酸在调节光敏剂的自组装方面是有效的,并且所获得的纳米粒子具有可调的大小和表面电荷,以及对 pH 值、洗涤剂和酶的多响应性,这表明,短肽调节的光敏剂自组装是一种简单而高效的方法来制备和递送光敏剂。除了预先组装的纳米粒子的例子之外,通过使用一种含酶响应肽的水溶性构建模块在体内实现了原位自组装以增强 PTT 的例子,为探索自组装肽用于光疗提供了一种替代方法。
尽管近期在基于自组装肽的纳米材料用于光疗方面取得了成功的成果,但这些纳米材料在临床转化方面仍面临诸多挑战。理想的光疗纳米材料应具备以下特点:(i)良好的生物相容性和可降解性,同时无暗毒性和不必要的免疫原性;(ii)在血液循环中稳定,并选择性地靶向和聚集于肿瘤;(iii)在近红外范围内有强吸收,以确保高效的光吸收和深层的光穿透深度;(iv)(四)用于光动力治疗(PDT)时具有较大的单线态氧量子产率,或用于光热治疗(PTT)时具有较高的光热转换产率。为了实现具有临床价值的光治疗纳米材料的目标,在光吸收分子、肽构建模块以及纳米材料的药代动力学方面仍需付出更多努力。例如,广泛研究的近红外染料中的一部分,如 IR820 和 IR825,具有毒性。尽管当它们被纳米颗粒封装时毒性降低,但长期安全性尚未得到证明,这可能对所形成的光治疗纳米材料的生物相容性产生潜在的负面影响。此外,大多数用于 PDT 研究的光敏剂只能被可见光激活,而不是近红外光,这限制了 PDT 的穿透深度。因此,迫切需要具有近红外吸收能力以及高生物相容性和生物可降解性的新型光敏剂。对于 PTT,另一个限制是相对较高的光强度(在已审查的报告中为 0.5 - 1.0 瓦/平方厘米),这是产生足够的热量以实现肿瘤消融所需要的。然而,在广泛应用的 808 纳米波长下,皮肤的最大暴露阈值约为 0.3 瓦/平方厘米。高强度光会对位于光路中的健康细胞和组织产生不良的副作用。降低光强度取决于光热纳米材料的有效递送,这些纳米材料具有增强的红外吸收能力和高光热转换率,以作用于肿瘤。对于自组装纳米结构,通过使用具有生物活性肽的序列,可以进一步定制肽构建模块,使其具有抗癌、抗菌和免疫调节活性。在这样的设计中,纳米结构将具有除作为负载光吸收分子的纳米载体之外的内在功能,提供了一种协同治疗的新方法。此外,大多数已报道的系统都缺乏详细的药代动力学/药效学分析,尽管这对于确定优化的治疗条件和证明光治疗剂的长期安全性非常重要。同时也是为了深入了解自组装纳米材料的体内行为,并为基于肽的纳米材料在光疗领域的进一步发展提供基础。
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除。