肽酰胺键会被多种蛋白酶和肽酶识别并切割,这些酶对线性肽序列和未改变的游离氨基和羧基末端尤其有效。因此,通过化学修饰N端(例如乙酰化)可以提高肽的稳定性。大多数肽酶识别L型氨基酸,因为大多数真核生物肽都由这种形式的氨基酸组成。因此,将L型氨基酸替换为相应的D型氨基酸(图1)可以使相应的肽更稳定。一个突出的例子是去氨加压素的开发。同样,N-甲基化会产生几乎不被肽酶识别的肽骨架。
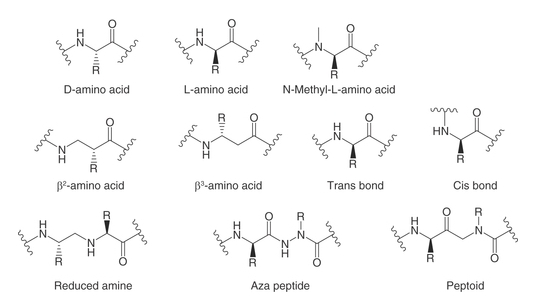
图 1. 非天然氨基酸及酰胺键等价物的结构。
大量不寻常或非标准的氨基酸能够提高治疗性肽的蛋白水解稳定性,因为它们不会被人体蛋白酶识别。这些所谓的非蛋白生成氨基酸(NPAAs)不在人类遗传密码中。许多NPAAs存在于生物体中,比如细菌和真菌,它们由非核糖体肽合成酶生成,从而产生具有高活性、稳定性和渗透性的非核糖体肽。例如万古霉素、环孢素等肽类药物就包含这些氨基酸,而且已有超过800种天然存在的NPAAs被报道。此外,通过现代化学和酶促合成技术,合成非天然氨基酸变得越来越容易,这为肽类药物开辟了新的应用领域;例如,它们可以包含用于交联的反应性侧链。体外选择方法,如mRNA展示和深度突变扫描,使得构建包含NPAAs的多样化肽库成为可能。D型氨基酸尤其被用于提高蛋白水解稳定性,例如在生长抑素(L-Trp到D-Trp)的开发中。N-烷基化(主要是N-甲基化)氨基酸也已被成功应用于提高蛋白水解稳定性,其中包括P物质、内皮素、神经降压素等化合物。在此,肽主链和靠近N-烷基基团的侧链的构象自由度受到影响,倾向于促进顺式键构型。同样,α-取代氨基酸通过引入肽主链的构象限制来提高稳定性,并且在天然肽中经常被发现。例如,α-氨基丁酸(Aib)提高了脑啡肽、缓激肽和血管紧张素II的稳定性。包含改变主链的非天然氨基酸(如β-和γ-氨基酸)在整体肽主链中添加了碳原子,从而提高了蛋白水解稳定性,改善了体内药代动力学。β-氨基酸有多种版本(β2或β3,图1),取决于侧链的位置,而由于商业可得性,β3更为常见。
除了增强稳定性之外,非天然氨基酸(NPAAs)还能提高效力。用1-甲基色氨酸替代色氨酸使补体抑制剂化合物的亲和力提高了十倍,这很可能是通过与目标蛋白C3建立新的疏水接触或屏蔽结合口袋中保守的水分子实现的。用4-氟苯丙氨酸(4-氟-Phe)替代苯丙氨酸极大地增强了双环FXIIa抑制剂的抑制活性,而引入β-同型精氨酸和D型氨基酸(D-精氨酸、D-丝氨酸)则提高了蛋白水解稳定性。已获批的含NPAAs的肽类药物有依卡替班、兰瑞肽和亮丙瑞林。然而,侧链含有非天然化学结构单元的NPAAs存在不良影响的风险,例如毒性或免疫原性。
另一种提高稳定性的策略是使用异构氨基酸替代物,即用诸如还原酰胺、氮杂肽和肽类等异构体取代肽键。这种策略在设计蛋白酶抑制剂方面尤其成功,因为这些异构体常常能模拟肽键断裂的过渡态。
通过环化(见克服膜通透性的策略一文)来限制肽链也已被证明是一种成功的策略,能提高肽的稳定性,因为内肽酶无法接触到肽键,尤其是对于头尾环化而言,由于缺乏氨基和羧基末端,因此能抵御外肽酶的降解。其他主要为延长循环半衰期而开发的策略(例如,与聚乙二醇或Fc结构域偶联)也已被证明能提高偶联肽的酶稳定性,这是由于屏蔽效应所致。例如,Fc偶联物可能免受酶切,同时通过neonatal FC受体的再循环延长循环时间,这将在另一篇文章:延长循环半衰期一文中介绍。
最近,已发现一种源自前阿黑皮素原的12个氨基酸肽序列(NSSSSGSSGAGQ),当添加在肽的C端或N端时,可增强肽的血浆稳定性,如对胰高血糖素样肽-1(GLP-1)所示。该序列模块的稳定作用与白蛋白无关,表明其可能直接作用于肾清除率。
参考文献:doi.org/10.4155/fdd-2022-0005