药物输送概念的主要挑战在于将足够剂量的细胞毒性药物输送到特定位置,同时将不良副作用降至最低。为克服这一难题,目前正采用多种方法。这些方法包括但不限于:a)利用药物输送载体和制剂,如纳米粒子、杯芳烃或环糊精,将细胞毒性药物装载其中,并在恶性肿瘤部位释放;b)在肿瘤微环境(如低 pH 值)中安装不稳定的化学基团,以掩盖细胞毒性药物,形成具有增强的血浆稳定性和/或细胞渗透性的前药,同时降低对正常细胞的毒性;c)将药物共价连接到肿瘤靶向元件(小分子、肽或抗体)上,使其能够选择性地靶向并渗透癌细胞。这种连接是通过合理设计的连接体实现的,该连接体能够在癌细胞微环境中释放药物
理想的靶向分子装置应包含以下模块:a)细胞毒性药物(药物),b)药物运输载体(例如脂质、甘露聚糖),c)将运输载体与细胞毒性弹头连接的连接体,d)“可编程”的导航/靶向部分(例如受体特异性配体),以及 e)“隐身”载体(例如聚乙二醇)以提高生物利用度。这些模块在图 1A 中以不同颜色编码:运输载体为绿色,药物为蓝色,连接体为红色,导航/靶向部分为黑色,“隐身”载体为灰色。
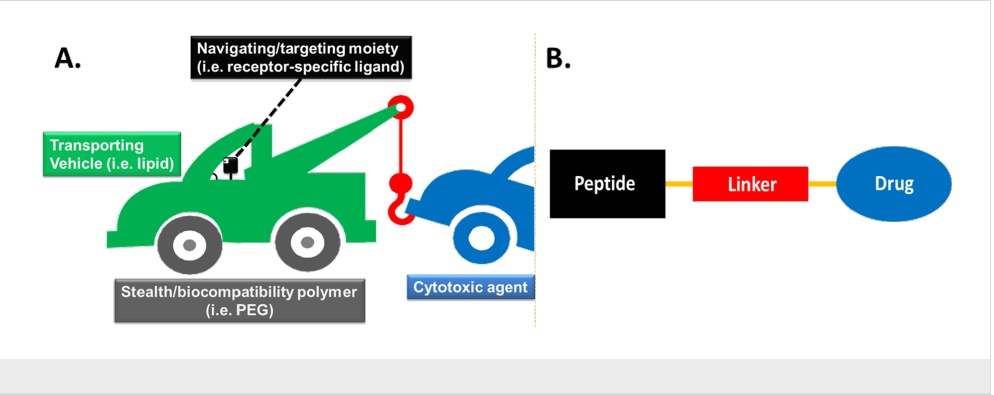
图1 理想的导航药物输送系统的总体结构架构。B. 肽-药物偶联物(PDC)的一般结构。
多肽药物偶联物(PDC)的治疗效果主要取决于药物的效力以及所组装偶联物的靶向效率。因此,多肽药物偶联物应具备某些特性,使其成为有吸引力的治疗候选药物:
1. PDC 中所含的肽必须选择性地且以最佳亲和力与特定受体结合,该受体存在于靶组织细胞的表面,而非细胞质或细胞核内(即类固醇受体)。
2.所选受体应在癌细胞上特异性表达或过度表达(通常与正常细胞相比高出 3 倍或更高)。此外,其表达水平应足以将有效剂量的药物泵入细胞内部。
3.肽载体应以这样的方式构建:能够与药物和/或荧光团进行偶联。偶联通常发生在赖氨酸、半胱氨酸和谷氨酸上,通过正交偶联或在固相肽合成过程中发生在肽的游离 N 端。不过,偶联位点应谨慎选择,因为肽结构微环境中的扰动可能会导致其与靶受体的结合亲和力/选择性丧失。
4.连接子的选择应谨慎,以确保肽偶联药物(PDC)发挥最佳性能。选择不当可能会导致肽与受体的结合亲和力降低,以及药物治疗窗缩小。此外,连接子在血液循环过程中应具有酶稳定性,以便有效到达恶性肿瘤部位,并在其微环境中释放有效载荷,从而降低脱靶毒性。
5.细胞毒性药物应含有能与肿瘤归巢肽连接的适当官能团(例如吉西他滨),若不存在则应合理添加,同时考虑细胞毒性药物的最终衍生物,以保持其原有的细胞毒性活性。
以下各节总结了选择性靶向恶性细胞的肽-药物偶联物的基本设计原则。
选择合适的靶向肽:
肽类物质(线性或环状)种类繁多,已被用作载体/靶向元素,成功地将细胞毒性弹头递送至癌细胞。这些肽类物质具有细胞特异性,能与特定受体结合,促进其内化。它们通常通过胞吞作用进入细胞,然后被运输到酶浓度更高、pH 值更低的细胞内区室,在那里它们与受体分离,随后与抗癌药物分离。用于 PDC 的代表性肽类物质示例如下。
RGD
一种广泛使用的肽载体是三肽精氨酸 - 甘氨酸 - 天冬氨酸(RGD)基序,该基序于 20 世纪 80 年代初由 Ruoslahti 和 Pierschbacher 在纤连蛋白中首次发现,纤连蛋白介导细胞附着,且已知其靶向整合素α5β1,由于肿瘤的发生高度依赖于迁移、侵袭和血管生成,因此整合素成为重要的抗癌靶点。整合素αvβ3是肿瘤血管生成和转移的重要因素,这是癌症区别于其他疾病的两个常见特征。值得注意的是,在细胞增殖、侵袭和血管生成方面,整合素αvβ3(也称为纤连蛋白受体)在所有整合素中显得最为重要。这种整合素在活化的内皮细胞、新生血管和其他肿瘤细胞中过度表达,但在大多数成年上皮细胞中表达水平极低,使其成为抗血管生成治疗的理想靶点。由于其在癌细胞中的高表达水平,含RGD基序的几种肽已被用于制备PDCs,其中最具代表性的例子是肽CDCRGDCFC。
促性腺激素释放激素(GnRH)
促性腺激素释放激素(GnRH),也称为促黄体生成素释放激素(LHRH),是一种负责从脑垂体前叶分泌两种促性腺激素——卵泡刺激素(FSH)和黄体生成素(LH)的激素。GnRH 由下丘脑内的 GnRH 神经元合成并释放,选择性地与其受体(GnRH-R)结合,该受体是一种七跨膜 G 蛋白偶联受体。GnRH 激素的结构(pGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2)于 1971 年由 Baba 等人首次发现。除了这种形式外,在大多数脊椎动物以及人类体内还发现了 GnRH-II(pGlu-His-Trp-Ser-His-Gly-Trp-Tyr-Pro-Gly-NH2)。这种肽通过一种类似的受体(II 型 GnRH-R)起作用,该受体在包括肿瘤细胞在内的不同组织中均有表达。另一种天然的 GnRH 同种型是 GnRH-III(pGlu-His-Trp-Ser-His-Asp-Trp-Lys-Pro-Gly-NH2),它是从海七鳃鳗中分离出来的。GnRH-III 与癌细胞表面过表达的 GnRH-R 结合,从而产生抗增殖作用,但在刺激垂体释放促性腺激素方面似乎不如其他 GnRH 类似物有效。
促性腺激素释放激素(GnRH)肽类似物构成了一类新兴的肿瘤归巢肽,用于针对表达 GnRH 受体(GnRH-R)的恶性组织。其开发基于这样一个事实,即特定的人类癌细胞(主要是卵巢癌、前列腺癌、肺癌和乳腺癌)相对于正常组织而言,会特异性表达或过度表达 GnRH-R。其中最常用的促性腺激素释放激素(GnRH)类似物是 D-Lys6-GnRH-I,它能选择性地与 GnRH 受体(GnRH-R)结合。将天然激素中的第 6 位甘氨酸替换为 D-Lys6,得到了一种结合亲和力更高、β 转角更稳定且能抵抗蛋白水解的类似物。此外,赖氨酸的侧链含有一个游离的氨基(εNH₂),这使得它能够与细胞毒性弹头进行正交偶联。基于 GnRH 的肽药物偶联物(PDC)数量众多。
生长抑素(SST)
生长抑素是一种由神经内分泌、炎症和免疫细胞产生的神经肽,在多种生理功能中发挥着重要作用,可作为经典的内分泌激素、旁分泌调节剂或神经递质。生长抑素有两种不同的活性形式:生长抑素-14(SST-14)和生长抑素-28(SST-28)。SST-14 和 SST-28 均通过高亲和力的膜受体(生长抑素受体 1-5;SSTR1-5)发挥生物活性,这些受体广泛分布于人体的各种组织中,如神经组织、垂体、肾脏、肺和免疫细胞。
生长抑素受体(SSTRs)在多种神经内分泌恶性肿瘤(NETs)中过度表达,包括胰腺、垂体、前列腺、肺类癌、骨肉瘤等,以及一些非神经内分泌肿瘤,如乳腺癌、结直肠癌、卵巢癌、宫颈癌等。因此,这些受体可作为靶点,用于将高效浓度的细胞毒性药物选择性地递送至肿瘤部位。然而,天然生长抑素会因酶促降解而迅速水解,因此开发出了更稳定且效力更强的类似物。这些类似物通过将 L-氨基酸替换为其 D-异构体,并保留仅负责生物活性的肽表位来缩短肽链而合成。最广为人知的生长抑素类似物是环肽,包括奥曲肽(d-Phe-c[Cys-Phe-d-Trp-Lys-Thr-Cys]-Thr-ol)、兰瑞肽(d-2Nal-c[Cys-Tyr-d-Trp-Lys-Val-Cys]-Thr-NH2)和伐普肽(d-Phe-c[Cys-Tyr-d-Trp-Lys-Val-Cys]-Trp-NH2),它们主要与 2 型受体(SSTR2)结合,而 SSTR2 是已知过度表达最频繁的生长抑素受体。有多个 PDC 的实例由上述生长抑素靶向肽组成,还有其他生长抑素肽类似物,例如五肽生长抑素(DTPA-d-Phe-c[Cys-Phe-d-Trp-Lys-Thr-Cys]-Thr-ol)
表皮生长因子(EGF)
表皮生长因子受体(EGFR)是一种跨膜蛋白,属于 ErbB 家族的受体酪氨酸激酶,该家族由 4 种结构相关的成员组成:EGFR/HER1(ErbB-1)、HER2/neu(ErbB-2)、HER3(ErbB-3)和 HER4(ErbB-4)。通过筛选噬菌体展示文库,已发现许多肽能以高亲和力和选择性与 EGFR 结合,并已被用作靶向药物递送的可行方法:YHWYGYT-PQNVI、CMYIEALDKYAC、LTVSPWY、YWPSVTL。
Angiopep-2:最近引起关注的一种肽是一个名为Angiopep-2(TFFYGGSRGKRNNFK-TEEY)的 19 肽,因其能够穿越血脑屏障(BBB)而备受瞩目。血脑屏障由脑内皮细胞构成,限制并控制着中枢神经系统与身体其他部位之间的分子交换。Angiopep-2能够通过与在脑细胞中过表达的低密度脂蛋白受体相关蛋白 -1(LRP-1)结合,经受体介导的转胞吞作用穿越血脑屏障。此外,其序列中含有的两个赖氨酸使其成为一种有吸引力的 PDC 候选物,旨在将治疗药物偷运至脑部恶性肿瘤。
针对上文所述的 RGD 肽基序,已开发出环肽变体。最常用的环肽是 iRGD(CRGDKGPDC),这是一种 9 个氨基酸的环肽,具有穿透肿瘤组织的活性。iRGD 初始与肿瘤内皮细胞中过表达的αVβ3 和αVβ5 整合素结合。随后发生蛋白水解切割,暴露出位于 C 端的隐匿 RXXK/R 基序(CendR 基序,C 端规则),该基序随后与神经纤毛蛋白-1(NRP-1)结合,激活内吞转运途径,从而增强抗癌药物向肿瘤的运输(图 2)
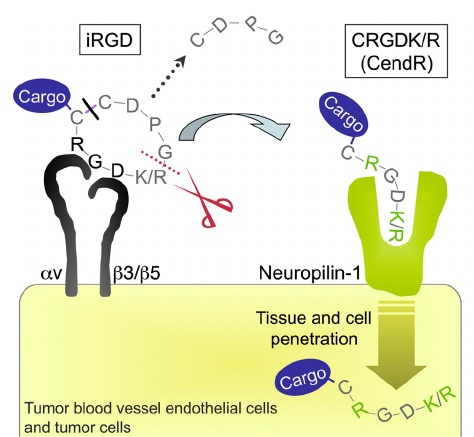
图2:iRGD 的结合与渗透机制。iRGD 肽在恶性肿瘤中表达αv 整合素的内皮细胞和其他细胞表面聚集。RGD 基序负责与整合素结合。随后,该肽被细胞表面相关蛋白酶切割,最终在 C 端(红色虚线)暴露隐匿的 CendR 元件 RXXK/R。CendR 元件随后干扰与神经纤毛蛋白 -1 的结合,从而实现组织和细胞渗透。肿瘤渗透肽可用于修饰货物(简单的化学基团或纳米颗粒),但前提是货物必须连接在 iRGD 肽的 N 端,因为肽在内化前二硫键已被切断(黑色线)
选择合适的偶联药物
目前有多种药物已被用作 PDC 中的毒性弹头,其中五个具有代表性的例子是吉西他滨、阿霉素、柔红霉素、紫杉醇和喜树碱(图3)。这些原始抗癌药物的主要缺点是其毒性不受控制,从而导致严重的副作用。如果不添加靶向部分,它们区分癌细胞和正常细胞的能力较低。此外,添加肽作为靶向载体可以提高药物的药代动力学和治疗窗口。由于不同的药物可能采用不同的机制来杀死细胞,因此会根据靶向癌细胞的特征来选择合适的药物。例如,柔红霉素和阿霉素的作用机制相似,而吉西他滨、喜树碱和紫杉醇的作用机制则各不相同。
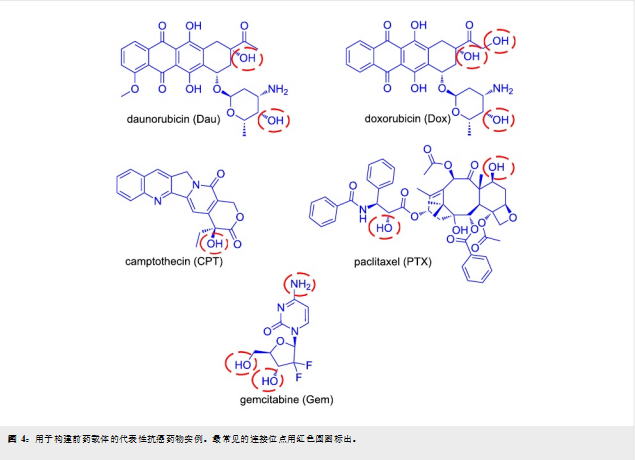
所选药物必须符合某些设计原则,才能成为 PDC 的理想候选药物。所选药物必须适合连接化学反应。它必须具有可直接与肽/连接子共轭的固有官能团(图3),或者具有能够衍生化以进行进一步共轭的官能团(例如,点击化学)。在后一种情况下,必须谨慎选择衍生化的位置,以免干扰药物的生物活性和活性药物的释放。如果药物通过识别特定受体进行结合,则必须采用计算机模拟方法来合理选择将进行化学修饰的药物位置。
此外,所选药物必须对选定的恶性肿瘤细胞具有足够的细胞毒性,以消除它们并进而促进肿瘤消退。理想情况下,所选药物对目标恶性肿瘤的半数抑制浓度(IC50)值应为低纳摩尔级。克服药物效力低的一个合理策略是增加肽载体的药物负载量。例如,在 PDC ANG1005 中,单个血管肽 -2 肽上负载了 3 个药物分子(紫杉醇),该药物已完成 II 期临床试验。然而,与通常更受青睐的单药负载相比,增加药物负载的概念难以实现,这主要是由于其物理化学性质不佳。
PDC的连接器设计
在设计肽药物偶联物(PDC)时,另一个需要考虑的关键方面是连接肽和药物的连接子。连接子的结构必须精心设计,以免影响肽与其受体的结合亲和力以及药物的疗效。不恰当的连接子可能会阻碍药物从 PDC 中释放,从而降低其整体治疗效果。用于 PDC 的连接子种类繁多,它们在长度、稳定性、释放机制、官能团、亲水性/疏水性等方面各不相同。
这种连接子可以设计成带有酶可水解单元(EHU),例如羧酸酯键或酰胺键,分别可被酯酶和酰胺酶水解。最常用于连接子中带有羧酸酯键作为酶水解单元的是琥珀酰基(源自琥珀酸)和戊二酰基(源自戊二酸)。关于在连接子中使用酰胺键作为连接药物和肽的单元,可以根据目标组织和/或癌症类型进行定制,以使其在特定的蛋白酶(如在包括肺癌、脑癌、前列腺癌和乳腺癌在内的多种恶性肿瘤中上调的组织蛋白酶 B)上调的部位被水解。此外,在设计 PDC 时,必须特别注意选择连接子中使用的键。具体而言,在目前可用的许多 PDC 中,至少使用了两种不同的键:一种用于将连接子连接到肽上,另一种用于将药物连接到连接子上。在设计过程中,此类情况必须考虑组装好的前药载体(PDC)所处的微环境,因为不同的酶和/或肿瘤微环境可能会导致药物从 PDC 中过早释放,即最终释放出携带药物的连接部分。
另一类连接体是刺激响应/可降解连接体,旨在实现药物从生物偶联物在肿瘤微环境中的高效释放。这类连接体经过合理设计,能够在癌细胞环境(微酸性 pH 值、还原剂和/或酶水平升高)或外部刺激(超声波、温度、辐射)下感知特定刺激时被切断。具体而言,某些键如亚胺键、肟键、腙键、邻酯键、缩醛键、乙烯基醚键和聚缩醛键,在酸性 pH 值条件下会发生水解,而在血液循环过程中却极其稳定。因此,酸敏感键能够在癌细胞的微酸性微环境和/或细胞内酸性区室中水解,从而释放出活性药物。此外,二硫键在抗体药物偶联物中也常被采用,因为它们会被恶性细胞中高浓度存在的半胱氨酸和谷胱甘肽等还原剂切断。
带有酶水解单元(EHU)且对蛋白酶有响应的连接子是可降解的肽连接子,由于某些酶的特异性,这类连接子引起了人们的极大关注,近年来其发展势头迅猛。该领域最具代表性的例子是基质金属蛋白酶(MMP-2/9)和组织蛋白酶 B 的肽底物。MMP-2/9 和组织蛋白酶 B 是在癌细胞中含量较高的蛋白水解酶,参与人类肿瘤的侵袭和转移。组织蛋白酶 B 能够识别特定的肽序列,如 Val-Cit(缬氨酸-瓜氨酸和GFLG。另一方面,GPLGIAGQ、PLGLAG和 GPVGLIGK 是基质金属蛋白酶 -2 和基质金属蛋白酶 -9 的一些常见肽底物。
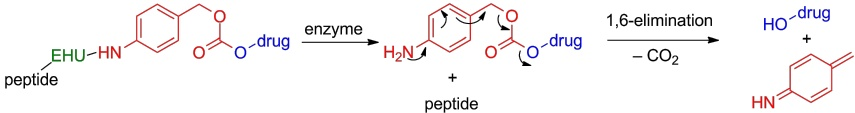
图4:通过酶水解单元将药物释放机制从自毁间隔物 PABC 与肿瘤归巢肽连接起来的图示。红色 = 自毁间隔物 PABC;蓝色 = 药物;绿色 = 酶水解单元(EHU);黑色 = 肿瘤归巢肽
在过去的几年中,聚乙二醇化药物偶联物(PDC)连接子中另一个迅速兴起且备受关注的类别是自消解或自毁性间隔基/连接子。这类间隔基/连接子能够通过级联反应同时释放活性药物,如图4所示。对氨基苄醇(PABC;红色部分)就是一个典型的例子,其氨基可以通过酰胺键与酶可水解单元(EHU;绿色部分)相连,同时与肿瘤靶向元件(如肿瘤归巢肽;黑色部分)相连。其另一端的羟基可以通过碳酸酯/氨基甲酸酯键与细胞毒性药物(蓝色部分)相连。EHU 被设计成靶向肿瘤微环境中过表达的蛋白酶(如组织蛋白酶 B)的底物。一旦被这些酶识别,EHU 就会被切割下来,从而通过快速级联反应释放出活性药物(图 4)
参考文献:Beilstein J. Org. Chem. 2018, 14, 930–954.doi:10.3762/bjoc.14.80