在本文工作中,开发了一种具有自递送功能的嵌合肽纳米棒(记为pnPNP),用于质膜和细胞核的双重靶向光敏剂递送,以实现原位协同光动力治疗。体外研究证明,这种双重靶向能力有助于pnPNP在质膜和细胞核中的高效亚细胞定位。pnPNP的质膜靶向光动力治疗能够提高膜通透性,从而增强细胞摄取,甚至直接引发膜破裂导致细胞坏死。在光照条件下,内化的pnPNP能够有效破坏溶酶体结构,并实现核渗透,以补充细胞核靶向光动力治疗。大量实验验证了质膜和细胞核双靶向光动力疗法(PDT)比单一细胞核靶向PDT具有更显著的抗肿瘤效果。这种协同的亚细胞双靶向策略最大限度地提高了PDT的治疗效果,也为先进药物递送系统的开发提供了新的思路。
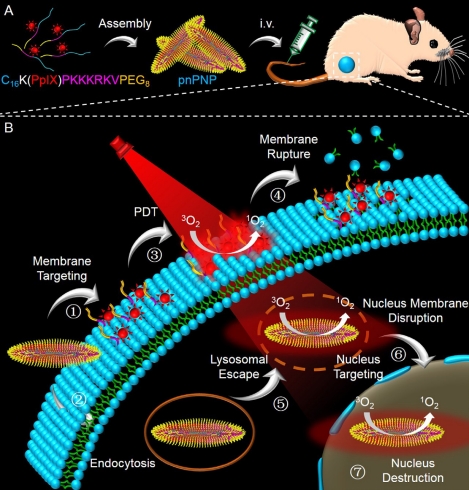
方案1.针对质膜和细胞核的光动力疗法的pnPNP示意图。(A)pnPNP的制备及静脉注射。(B)pnPNP针对质膜和细胞核的光动力疗法的拟议过程。pnPNP针对质膜的靶向递送;pnPNP通过内吞作用进入细胞内;通过光动力疗法在质膜原位生成活性氧;活性氧诱导质膜破裂;活性氧诱导pnPNP从溶酶体逃逸;活性氧诱导细胞核膜破裂及pnPNP针对细胞核的靶向递送;活性氧诱导细胞核被pnPNP破坏
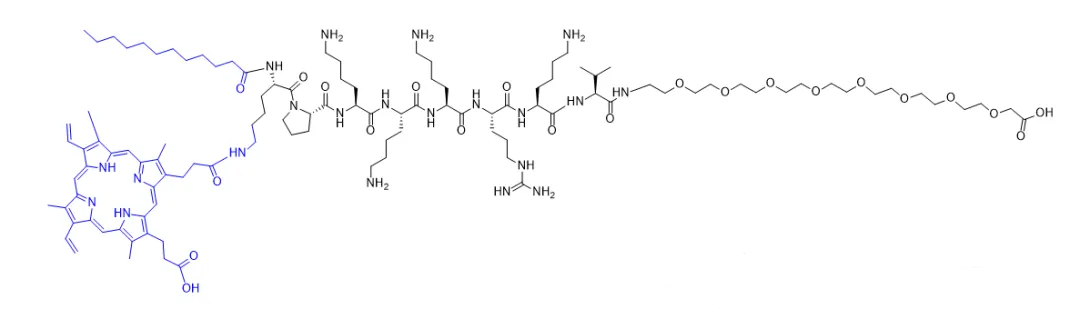 如方案1所示,嵌合肽(C16-K(PpIX)-PKKKRKV-PEG8)由用于血浆膜靶向的疏水烷基链(C16)、用于光动力治疗(PDT)的光敏剂PpIX、用于核转位的NLS肽(PKKKRKV)以及亲水性PEG链组成。pnPNP的血浆膜靶向PDT可直接诱导细胞坏死,并增强膜通透性以提高细胞摄取。随后,光诱导的内体/溶酶体破坏将促进内化的pnPNP从溶酶体逃逸。在NLS肽的作用下,预期pnPNP自组装的带正电荷纳米棒在光照下有助于核渗透。同时,原位产生的活性氧(ROS)会对DNA链造成显著的氧化损伤,从而为补充的核靶向PDT提供支持。为了突出pnPNP双靶向光动力疗法的优势,在本研究中设计了另一种具有单一核靶向的纳米棒(记为pnNP)用于对比。
如方案1所示,嵌合肽(C16-K(PpIX)-PKKKRKV-PEG8)由用于血浆膜靶向的疏水烷基链(C16)、用于光动力治疗(PDT)的光敏剂PpIX、用于核转位的NLS肽(PKKKRKV)以及亲水性PEG链组成。pnPNP的血浆膜靶向PDT可直接诱导细胞坏死,并增强膜通透性以提高细胞摄取。随后,光诱导的内体/溶酶体破坏将促进内化的pnPNP从溶酶体逃逸。在NLS肽的作用下,预期pnPNP自组装的带正电荷纳米棒在光照下有助于核渗透。同时,原位产生的活性氧(ROS)会对DNA链造成显著的氧化损伤,从而为补充的核靶向PDT提供支持。为了突出pnPNP双靶向光动力疗法的优势,在本研究中设计了另一种具有单一核靶向的纳米棒(记为pnNP)用于对比。
结论:
总之,开发了用于靶向细胞膜和细胞核的光动力治疗的自组装嵌合肽纳米棒(pnPNP)。无需额外载体,pnPNP具有高载药率和出色的产生活性氧(ROS)的能力。在光照射下,靶向细胞膜的pnPNP能够原位激活ROS,破坏细胞膜导致细胞坏死,并提高膜通透性以增强细胞对pnPNP的摄取。此外,内化的pnPNP通过光诱导破坏内体/溶酶体实现溶酶体逃逸。得益于核定位信号肽和正表面电荷,pnPNP的自组装纳米棒能够穿透细胞核。特别是,在光触发破坏核膜后,pnPNP的核内递送可进一步增强,对DNA链造成氧化损伤,从而实现补充的核靶向光动力治疗。静脉注射后,pnPNP通过增强渗透滞留效应实现肿瘤优先积累,用于协同光动力肿瘤治疗。体外和体内研究均表明,pnPNP的亚细胞双靶向光动力治疗效果远优于其他方法。与单核靶向光动力疗法(PnNP)相比,其抗肿瘤效果更佳,这进一步证实了这种亚细胞双靶向策略在最大限度提高光动力疗法疗效和最小化全身副作用方面的巨大优势。更重要的是,该策略弥补了传统单质膜或单核靶向光动力疗法的缺陷,并为更智能的纳米药物递送系统(NDDSs)的发展以实现精准肿瘤治疗提供了新的范例。
参考文献:doi.org/10.1016/j.apmt.2019.04.017